Výzkum
Výzkum
Vedoucí oddělení:
Mgr. Tereza Toralová, Ph.D.
|
|
|
Regulace zrání oocytů a preimplantačního vývoje savců
Laboratoř vývojové biologie se zaměřuje na expresi jednotlivých genů a proteinů v průběhu meiotické maturace oocytů a časného embryonálního vývoje savců. Jako model používáme oocyty a embrya prasete a skotu, kultivované v podmínkách in vitro.1) Identifikace genů a signálních drah regulujících zrání a vývojovou kompetenci oocytů
2) Mechanizmus embryonální aktivace genomu během preimplantačního vývoje
3) Molekulární studie nukleolární dědičnosti.
Geny a signální dráhy regulující zrání oocytů a jejich vývojovou kompetenci
Během růstu je zrání oocytů zablokováno v profázi I. meiotického dělení, avšak oocyt získává v několika krocích schopnost dokončit meiotické zrání – meiotickou kompetenci. Tyto meioticky kompetentní oocyty však zůstávají I nadále blokovány v meiotické profázi a znovuzahájí zrání in vivo až po preovulační vlně luteinizačního hormonu (LH), nebo in vitro, po uvolnění z folikulů do vhodného kultivačního media. Znovuzahájení meiozy je regulováno na úrovni oocytu post-translačními mechanizmy a nezávisí na aktivaci genové exprese v oocytu. Nicméně, preovulační vlna LH způsobuje dramatickou změnu genové exprese v somatických buňkách obklopujících oocyt, tedy v buňkách granulózních a kumulárních. Tyto změny genové exprese jsou regulovány širokou sítí signálních drah aktivovaných ve folikulárních buňkách pomocí LH.
Zrání oocytů prasete
Naše laboratoř se dlouhodobě zabývá molekulárními mechanizmy zrání oocytů savců a to zejména způsobem, jakým somatické folikulární buňky regulují meiotický blok a znovuzahájení meiozy oocytů. Pomocí polymerázové řetězové reakce, mikročipové analýzy a immunoblotingu identifikujeme na modelu prasete geny a proteiny granulozních a kumulárních buněk, které se účastní regulace meiotického zrání oocytů. Zvláštní pozornost věnujeme charakterizaci signálních proteinů a signálních kaskád, které jsou aktivovány ve folikulu gonadotropními hormony a modifikovány lokálně produkovanými EGF-like peptidy (Procházka et al., 2012; Blaha et al., 2015).
Vývojová kompetence oocytů
Vývojovou kompetenci získávají oocyty postupně během folikulogeneze a souvisí tudíž s velikostí folikulu. V několika pracích bylo prokázáno, že oocyty pocházející z velkých antrálních folikulů vykazují vyšší schopnost vývoje po oplození do stadia blastocysty. Tyto rozdíly ve vývojové kompetenci oocytů mohou být ovlivněny různými cytoplazmatickými faktory, například obsahem molekul mRNK. V naší laboratoři jsme charakterizovali pomocí mikročipové technologie rozdíly v genovém expresním profilu oocytů s vyšším vývojovým potenciálem pocházejících z folikulů středního průměru (MF) a oocytů s nižším vývojovým potenciálem z malých folikulů (SF). Zjistili jsme signifikantní rozdíly u 60 transkriptů (≥1.4 násobek), přičemž transkripce 49 genů byla zvýšená a 11 genů snížená při srovnání oocytů z MF a SF. Většina rozdílně exprimovaných genů byla spojena s regulací transkripce, translací, buněčným cyklem a aktivitou mitochondrií. Zdá se tak, že vývojová kompetence oocytů a časných embryí skotu je ovlivněna malými změnami transkripčního profilu velkého množství genů (Němcová et al., 2016). Další aktivita laboratoře je zaměřena na zdokonalení systémů kultivace oocytů in vitro a na detekci vysoce kvalitních oocytů molekulárně genetickými metodami.
Embryonální aktivace genomu během preimplantačního vývoje
Vývoj savčího embrya navazuje na maturaci oocytů a v období před implantací je charakterizován třemi hlavními vývojovými přechody, ke kterým dochází po oplození oocytu – přechod od oocytární kontroly ke kontrole vývoje embryonálním genomem (zygotic gene activation – ZGA), kompaktace (jejímž výsledkem je polarizovaný epitel) a diferenciace moruly do blastocysty. ZGA představuje proces, který zahrnuje degradaci maternální mRNA v koordinaci s počátkem transkripce a následné translace mRNA syntetizované na základě embryonálního genomu. K aktivaci embryonálního genomu u myši dochází již na 2-buněčném stadiu, tedy velmi časně. Této hlavní aktivaci dokonce předchází transkripce začínající již na 1-buněčném stadiu, v samčím pronukleu. U embrya skotu je genom plně aktivován v pozdním 8-buněčném stadiu, existují však práce, popisující „minor activation“ již na 2-buněčném stadiu. Na rozdíl od myši, kde zrání oocytů a reprogramace genové exprese jsou dobře popsána, u oocytů a embryí prasete a skotu stále zůstává celá řada nerozřešených otázek. Oocyty a embrya těchto druhů jsou přitom lepším modelem pro oogenezi a embryogenezi člověka než oocyty a embrya hlodavců.
Role nuklefosminu
Nuklefosmin byl vybrán pro tuto studii jako gen, který je s vysokou pravděpodobností důležitý pro preimplantační vývoj skotu. Zjistili jsme totiž, že embryonální transkripce nuklefosminu začíná v průběhu hlavní vlny aktivace embryonálního genomu, což naznačuje jeho nezbytnost pro další vývoj. Dále jsme zjistili, že úroveň mRNA pro nuklefosmin se snižuje z MII stadia do časného 8-buněčného stadia a začíná se opět zvyšovat v pozdním 8-buněčném stadiu. Toto zvýšení je citlivé na α-amanitin (inhibitor RNA polymerázy II) a představuje tak začátek transkripce z embryonálního genomu. Následně jsme zjišťovali pomocí RNA interference vliv umlčení mRNA pro nuklefosmin na časnou embryogenezi. Naše výsledky ukazují, že malé množství nuklefosminu je uchováváno v průběhu celého preimplantačního vývoje a umožňuje tak vývoj embrya do stadia blastocysty (Toralová et al., 2012).
SCF komplex
V současnosti nejdůležitější oblast našeho výzkumu v oblasti embryonálního vývoje skotu představuje ubikvitinace. Soustředili jsme se na komplex Skp1-Cullin1-Fbox (SCF), expresi jeho jednotlivých kompotent (Cullin1, Skp1, Rbx1) a jeho podílu na degradaci maternálních proteinů. Naše doposud dosažené výsledky ukázaly, že embryonální exprese všech těchto genů začíná v časných stadiích vývoje. Zvláště Cullin1 je aktivován velice časně, již na 4-buněčném stadiu. Geny, účastnící se ubikvitinace, jsou obvykle aktivovány na 8-buněčném stadiu, časná aktivace Cullin1 tedy předpokládá jeho nezbytnost pro aktivaci embryonálního genomu. Analýza lokalizace jednotlivých proteinů ukázala zajímavé výsledky hlavně na stadiu blastocysty, kde je viditelná lokalizace exprese proteinu a aktivace SCF komplexu do buněk trofektodermu (Benešová et al., 2016).
Molekulární studie nukleolární dědičnosti
Buněčné jadérko (nucleolus) představuje organelu zodpovědnou za syntézu ribozomů a tudíž i za syntézu proteinů. V savčích oocytech s ukončeným růstem jadérko vytváří kompaktní denzní sféru (nukleolární sféru), která nevykazuje ribozomy-syntetizující aktivitu.
Elegantní studie, provedené na modelu myšího a prasečího oocytu a využívající metodu mikrochirurgického odstranění nukleolárních sfér (enukleolace) či dokonce jejich výměny, prokázaly, že nukleolární sféra je naprosto nezbytná pro dokončení meiozy oocytu i pro další embryonální vývoj. Oocyty s odstraněnou nukleolární sférou nepodporovaly po oplození embryonální vývoj; pokud však došlo k nahrazení této sféry jinou, pocházející z jiného oocytu, došlo k obnovení vývojové kapacity oocytů. Není bez zajímavosti, že pokud byly k transplantaci použity nukleolární sféry pocházející ze somatických či dokonce embryonálních kmenových buněk, k obnovení vývojové kapacity oocytů nedošlo. Tudíž, komponenty přenesené z nukleolárních sfér oocytu do vyvíjejícího se embrya nejsou toliko nukleolární materiál, ale obsahují další biomolekuly, které jsou nepostradatelné pro vývoj embrya. Na základě těchto studií můžeme konstatovat, že nukleolární sféry oocytu jsou nezbytné pro početí i další vývoj jedince. Zatím však není známo, jaké komponenty nukleolární sféry obsahují a jakým způsobem přispívají k regulaci embryonálního vývoje. V našem projektu využíváme oocyty prasete ke studiu molekul obsažených v nukleolárních sférách a k charakterizaci vývojové kompetence přenesené touto strukturou do časných embryí. Obsah nukleolárních sfér bude analyzován transkriptomickými a proteomickými metodami a vývojová kompetence bude testována pokročilými mikromanipulačními metodami, využívajícími transplantaci nukleolárních sfér mezi dvěma oocyty.
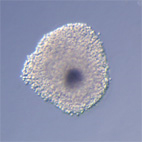 |
Oocyt-kumulární komplexy prasete po kultivaci in vitro v médium s dbcAMP. |
 |
Konfokální laserová skenovací mikroskopie polymerizace tubulinu a detekce nuclephosminu u embrya skotu po imunofluorescenční analýze. Alfa-tubulin (zeleně), nuklefosmin (červeně), jádra (modře). Toralová et al. 2012, Bovine preimplantation embryos with silenced nucleophosmin mRNA are able to develop until the blastocyst stage. Reproduction 144, 349-359. |
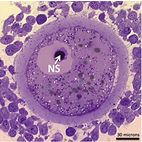 |
Histologický řez oocyt-kumulárním komplexem prasete s vyznačenou nukleolární sférou. |
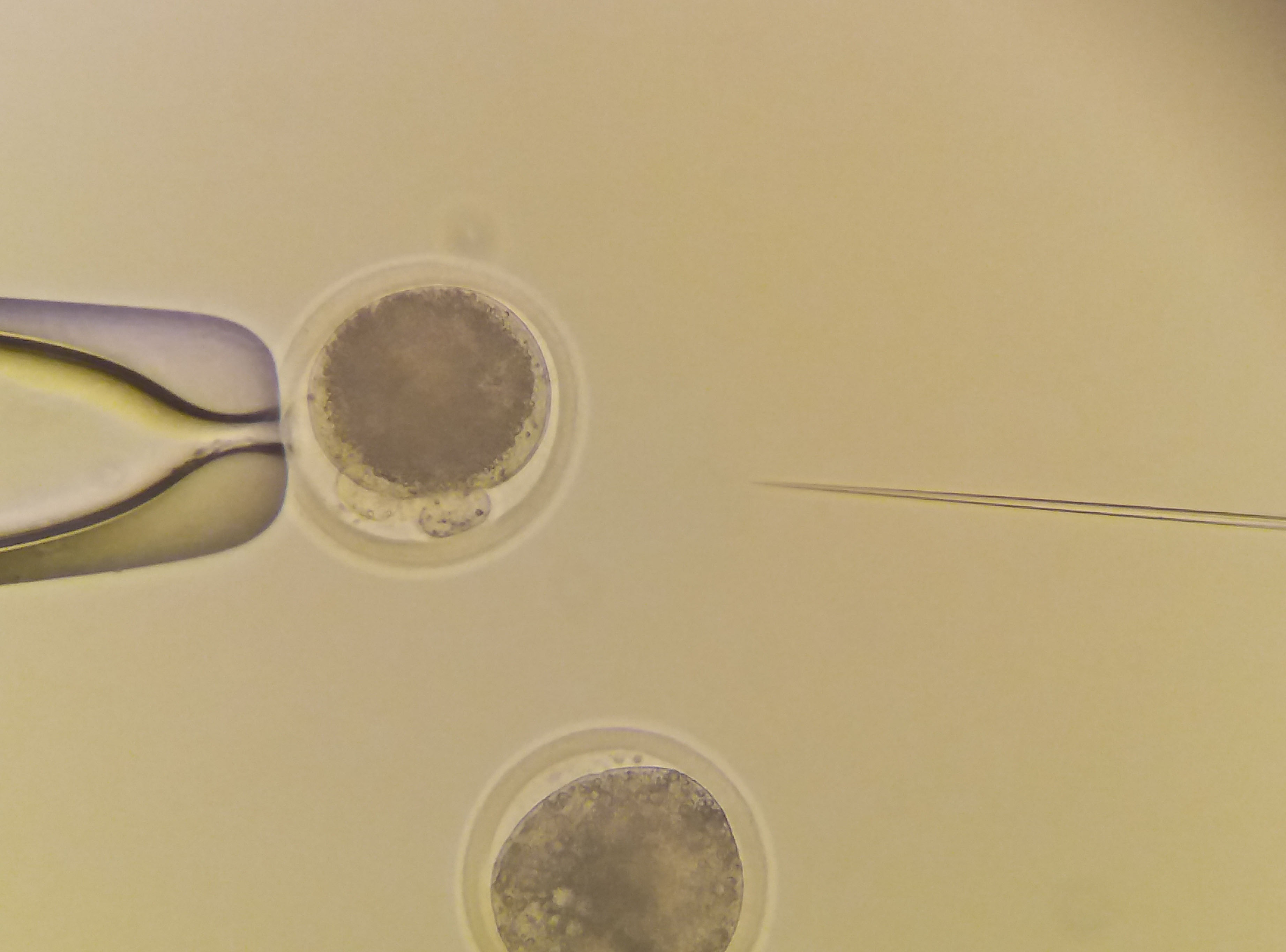 |
Mikroinjikace do bovinních zygot. |
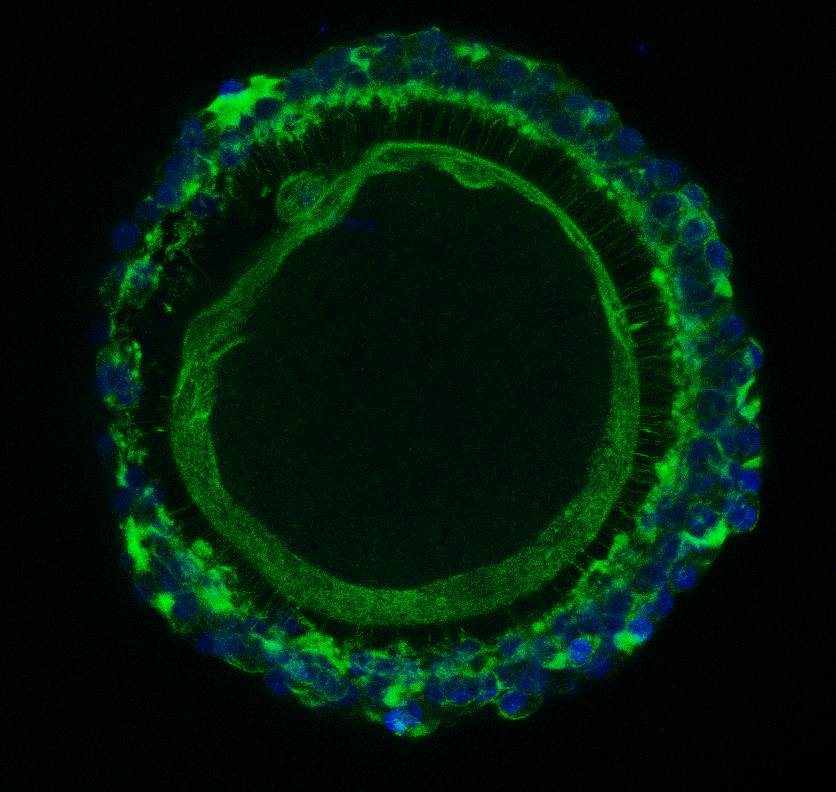 |
Detekce F-aktinu u bovinního oocytu obklopeného kumulárními buňkami. F-aktin - zeleně, DNA - modře. |
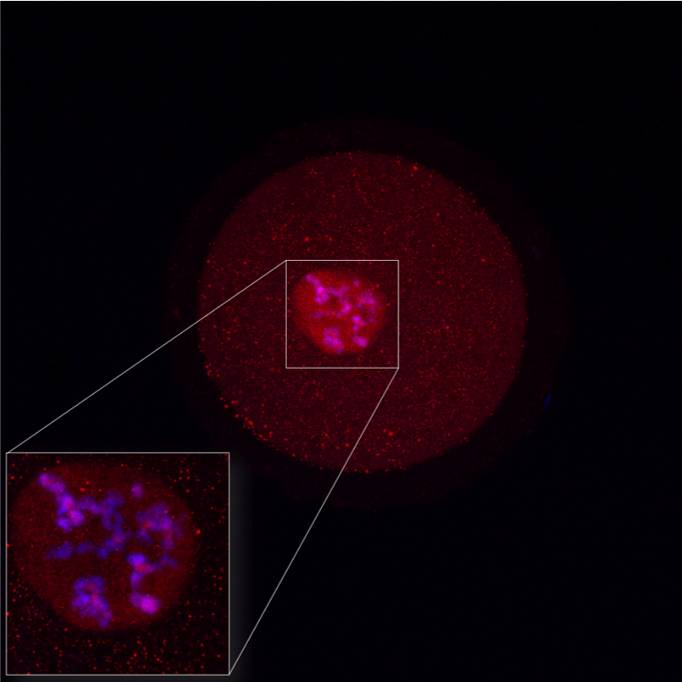 |
Detekce lokalizace proteinu (PIASy) u GV oocytu skotu se zaměřením na detail lokalizace v jádře. Červeně- protein, modře - DNA. |
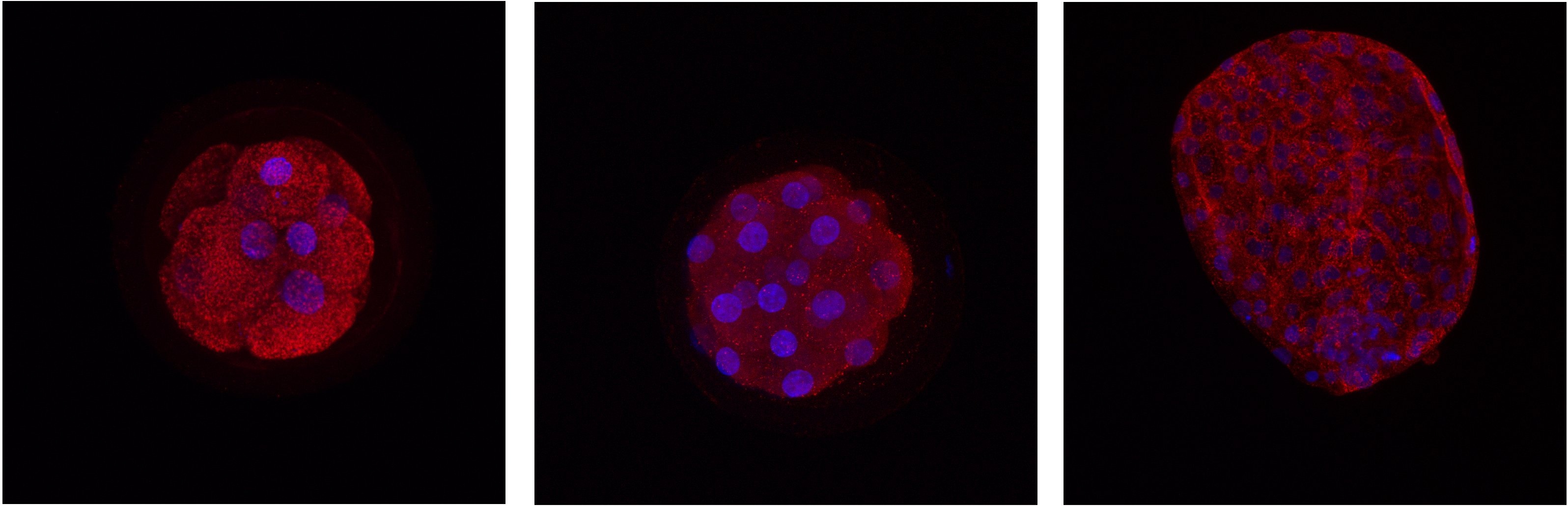 Detekce proteinů v rozdílných embryonálních stádiích skotu. Červeně - protein, modře - DNA.
Detekce proteinů v rozdílných embryonálních stádiích skotu. Červeně - protein, modře - DNA.