Výzkum
Výzkum
Vedoucí oddělení:
Vodička Petr, Mgr., Ph.D.
 |
|
Videospot laboratoře
Odkaz pro stažení videa a titulků.
Činnost oddělení:
V roce 2002 byla v rámci Laboratoře biochemie a molekulární biologie zárodečných buněk ÚŽFG AV ČR založena proteomická skupina. S posunem oblasti studia z původního zaměření na biologii reprodukce na studium neurobiologie a nádorové biologie byla v roce 2013 založena samostatná Laboratoř aplikovaných proteomových analýz (LAPA) jako součást výzkumného centra PIGMOD. V roce 2017 se LAPA sloučila se skupinou Laboratoře nádorové biologie.
Současný výzkum LAPA je zaměřen na dvě hlavní oblasti:
- Neurobiologická skupina studuje patogenezi neurodegenerativních onemocnění na zvířecích a buněčných modelech Huntingtonovy nemoci (HN) a proces diferenciace nervových kmenových buněk.
- Skupina nádorové biologie studuje mezibuněčnou komunikaci mezi buňkami nádoru a nádorového stromatu (ve spolupráci s Prof. Karlem Smetanou na 1. Lékařské fakultě Univerzity Karlovy v Praze) a nádorovou imunologii na prasečím modelu maligního melanomu (Melanoma-bearing Libechov Minipig, MeLiM).
Tyto dvě výzkumné oblasti spojuje společný metodický přístup, založený na studiu buněčných populací, jejich proteomů a sekretomů pomocí protilátkových a na protilátkách nezávislých metod, jako je imunocyto a imunohistochemie, průtoková cytometrie, multiplexní imunoanalýzy a proteomika založená na hmotnostní spektrometrii. Další spojující oblastí je zaměření na využití miniaturního prasete jako zvířecího modelu. Miniprase transgenní pro fragment mutovaného lidského huntingtinu je využíváno jako model Huntingtonovy nemoci a kmen miniprasete s dědičnou formou maligního melanomu slouží jako model pro výzkum nádorové biologie.
Mezinárodní spolupráce:
- Prof. Martin Marsala, Department of Anesthesiology, University of California San Diego, CA, USA
- Prof. Paola Picotti, Institute of Biochemistry, ETH Zurich, Switzerland
- Prof. Marian DiFiglia, MGH MIND/Harvard Medical School, Charlestown, MA, USA
Přístrojové vybavení:
- Hmotnostní spektrometry Sciex TripleTOF 5600+ and Sciex QTRAP 5500 spojené s kapalinovou chromatografií Eksigent nanoLC 425
- Luminex 200 Multiplexní imunoanalyzátor založený na principu průtokové cytometrie fluorescenčně značených mikrokuliček
- Průtokový cytometr a buněčný sorter BD FACS Aria
- Skener fluorescenčních gelů a membrán Bio-Rad PharosFX
- Vybavení pro 2D gelovou elektroforézu a 2D HPLC separaci proteinů
- Mikrodestičkový analyzátor BioTek Synergy
- Konfokální mikroskop Leica SP5, invertovaný fluorescenční mikroskop Olympus IX73.




Skupina neurobiologie
Výzkum:
Huntingtonova nemoc (HN)
Huntingtonova nemoc je dědičné neurodegenerativní onemocnění s autozomální dědičností. Mutace v genu pro huntingtin vede k zmnožení tripletu CAG, který kóduje prodloužený řetězec glutaminů. To vede k agregaci proteinu huntingtinu a k jeho toxickému působení na buňky, zejména na střední ostnité neurony striata.
S využitím transgenního prasečího modelu HN studujeme změny v hladinách proteinů spojených s postupem onemocnění. Doufáme, že nalezneme změny, které nám umožní lépe pochopit průběh onemocnění a poslouží jako znaky pro klinické sledování průběhu onemocnění a sledování účinku terapií. Proto se zaměřujeme zejména na změny detekovatelné v krevní plasmě a mozkomíšním moku, včetně změn v hladinách proteinů komplementu a analýze cytokinů.
Zajímá nás také mechanismus toxicity mutovaného huntingtinu a role autofágie v patogenezi HN.
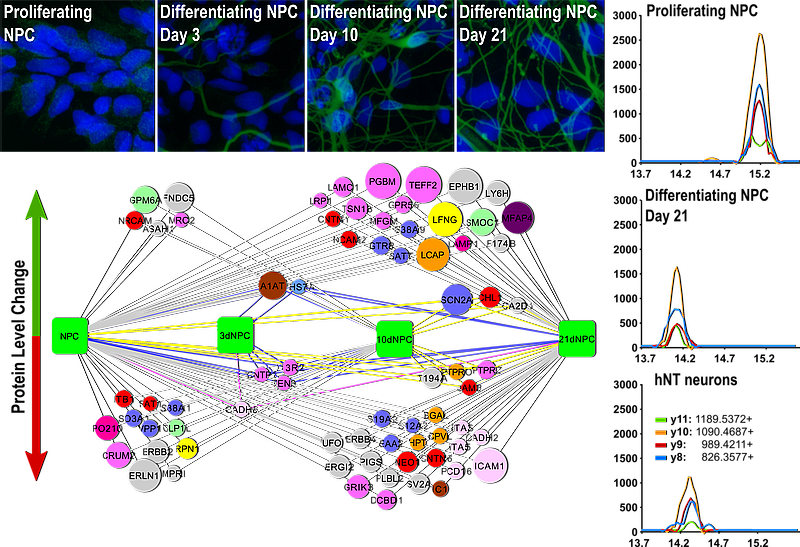
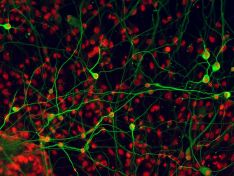
Nervové kmenové buňky
Nervové kmenové buňky představují jednak potenciální zdroj buněk pro buněčné terapie nervového systému a také modelový systém pro studium procesu diferenciace buněk během vývoje nervového systému.
Studujeme změny ve složení povrchových proteinů nervových kmenových buněk a jejich diferencovaných potomků, s cílem identifikovat znaky, které by umožnili cílený výběr požadovaných buněčných populací. Zajímáme se také o změny ve složení sekretovaných proteinů a exosomů a jejich role při formování mikroprostředí nervových kmenových buněk a při řízení jejich diferenciace.


Skupina nádorové biologie
Výzkum:
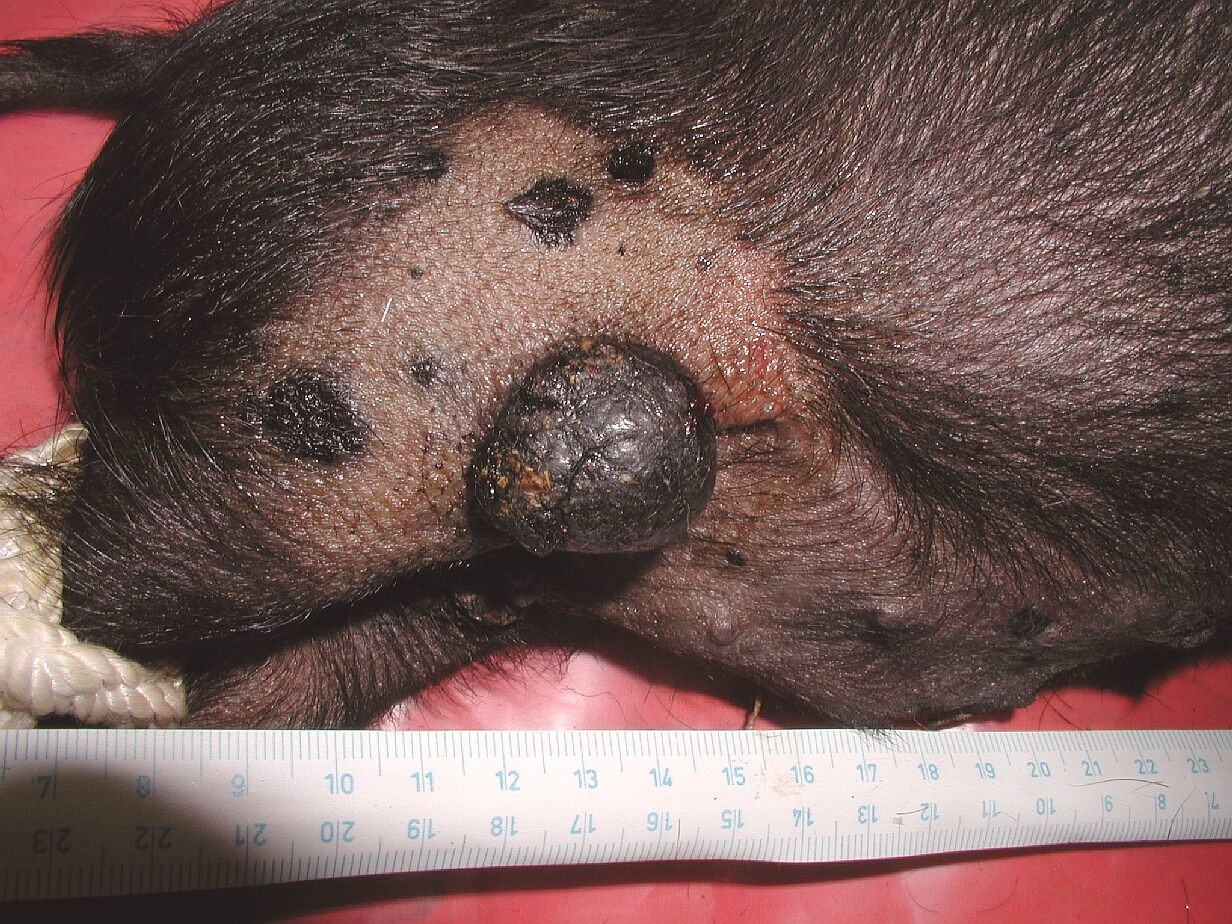
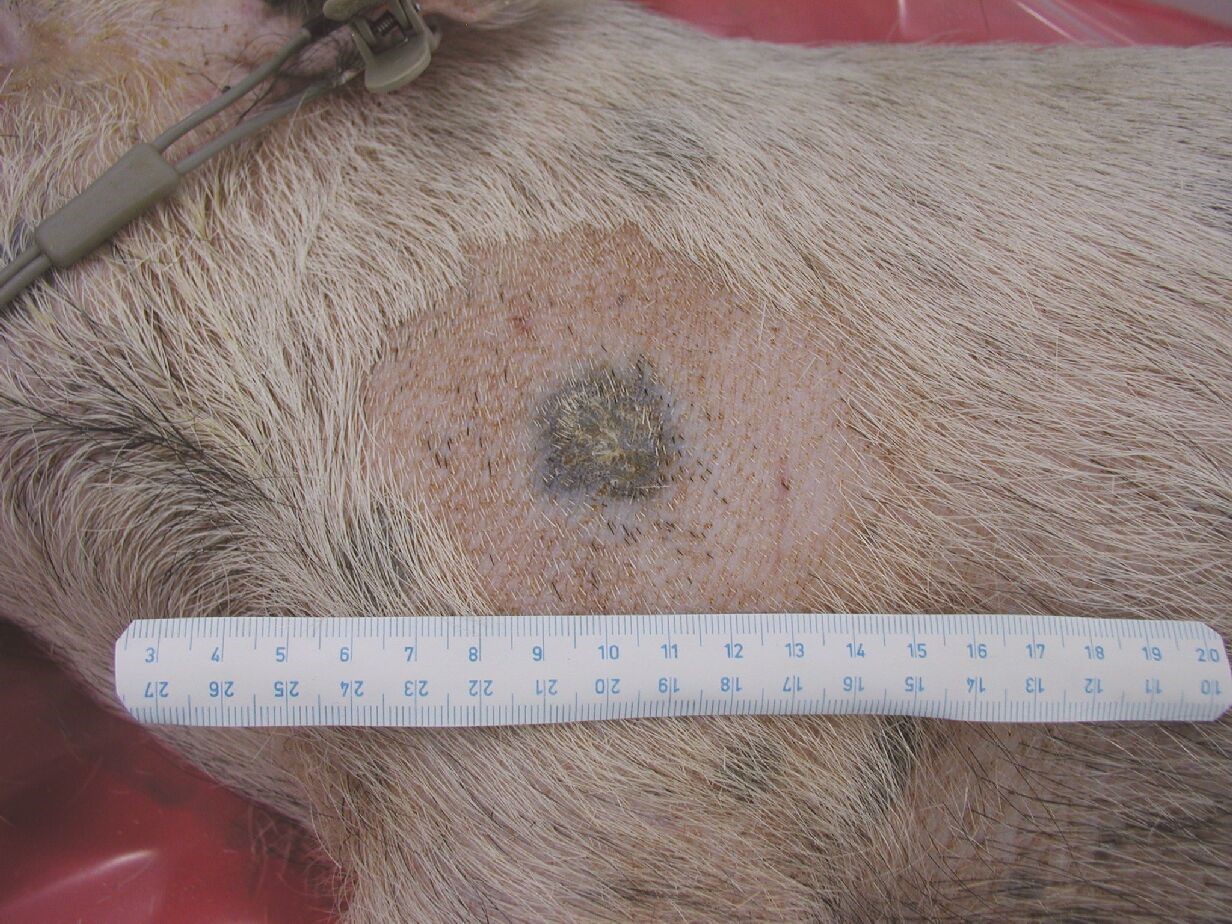
Melanom, nádor způsobený maligní transformací pigmentových buněk – melanocytů, je jedním z nejzhoubnějších forem rakoviny kůže. V posledních desetiletích jeho výskyt neustále vzrůstá zejména v bělošské populaci. Standardní léčba lokalizovaného melanomu spočívá v jeho chirurgickém odstranění, a je vysoce účinná. Pokud ale melanom přejde do metastatické formy, je prognóza většinou špatná, přes využití chirurgie, chemo-, imuno- nebo radioterapie. Proto existuje značný zájem o vhodné zvířecí modely pro studium biologie melanomu a vývoj nových léčebných přístupů.
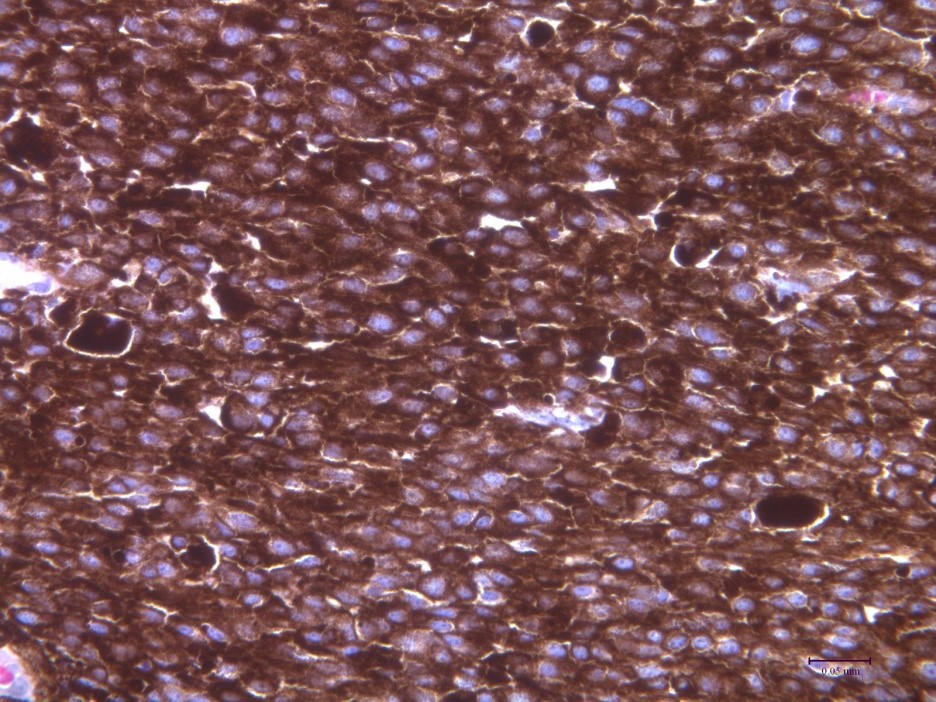
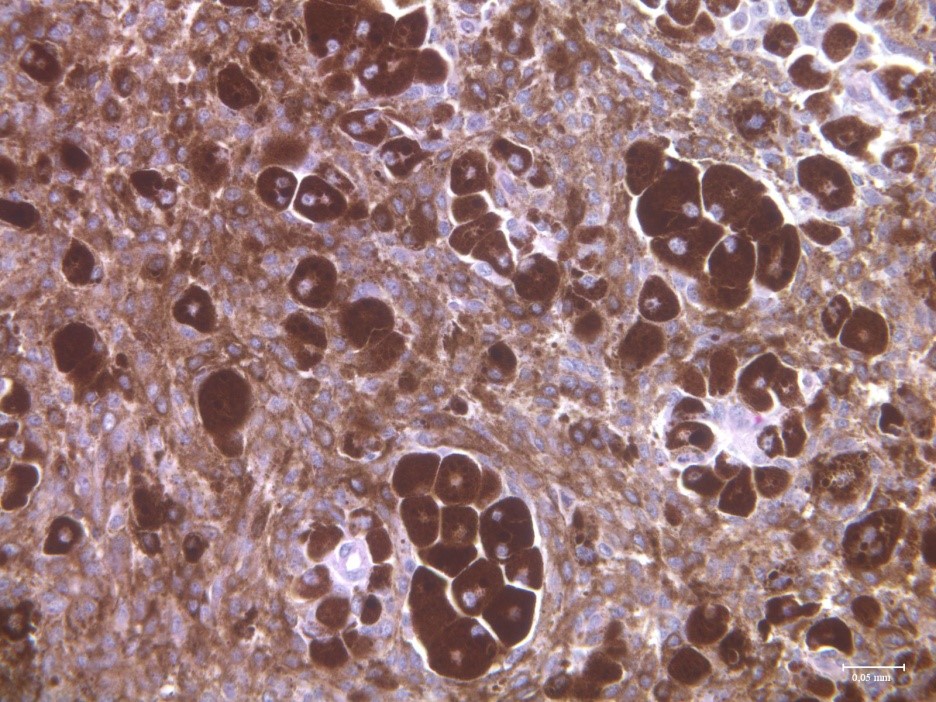
V ÚŽFG v Liběchově jsme cíleným výběrem vytvořili linii miniaturních prasat s dědičným výskytem maligního melanomu - MeLiM (Melanoma-bearing Libechov Minipigs). Mnohočetné kožní nodulární nádory (tj. nejagresivnější forma melanomu) se vyskytují zhruba u poloviny zvířat na různých částech těla. Rozsáhlá diseminace melanomových buněk vede u postižených zvířat ke vzniku orgánových metastáz. Histologické, imunohistochemické a biochemické analýzy jasně prokázaly maligní chování MeLiM melanomu a jeho značnou podobnost s lidským melanomem. Zhruba u 10-15% miniprasat dochází v důsledku progrese melanomu k jejich úhynu. U zbylých zvířat je možné pozorovat aktivaci protinádorové imunity a spontánní regresi nádorového onemocnění.
V současnosti studujeme příčiny a proces této spontánní regrese a potenciální využití tohoto mechanismu pro klinickou imunoterapii melanomu. Zajímáme se také o vliv mikrobiomu na modulaci imunitního systému a postup nádorového onemocnění. Další oblast výzkumu je zaměřena na mapování distribuce metalothionenů a kovů v nádorové tkáni. Ve spolupráci se skupinou prof. Karla Smetany na 1. Lékařské fakultě Univerzity Karlovy v Praze studujeme hladiny cytokinů v séru pacientů s maligním melanomem, s cílem porovnat stav pacientova imunitního systému s odpovědí na protinádorovou terapii.